Eu gostaria de acrescentar algo à resposta de Brian e também apontar algumas imprecisões.
Em primeiro lugar, não é verdade que os minerais félsicos têm temperaturas de fusão mais baixas do que os minerais máficos . Aqui estão algumas temperaturas de fusão de minerais comuns, classificados de alta a baixa:
- Forsterita (máfico): 1890 ° C
- Quartzo (félsico): 1713 ° C
- Anortita (félsica): 1553 ° C
- Diopsídio (máfico): 1391 ° C
- Fayalita (máfico): 1205 ° C
- Sanidina (félsica): 1150 ° C
- Albita (félsica): 1118 ° C
Observe que esta ordem difere da ordem na série de Bowen. Não há nenhum problema com isso, porque a série de Bowen descreve a ordem de cristalização em magmas comuns (como Brian identificou corretamente) e não a cristalização ou temperatura de fusão dos minerais. Embora esses dois estejam intimamente relacionados, eles não são idênticos.
Então, o que dita a ordem dos minerais na série de Bowen? É aqui que fica complicado. As temperaturas de fusão fornecidas acima aplicam-se apenas a minerais puros em pressões atmosféricas. Magmas de resfriamento nunca estão na composição exata de um mineral puro e raramente estão na pressão atmosférica. A mistura de componentes ( i.e. minerais) em um único magma irá deprimir as temperaturas de cristalização de todos os componentes e, portanto, as temperaturas de fusão. Pense no gelo em uma estrada: você pode derretê-lo aquecendo-o ou adicionando sal. Adicionando um segundo componente ( $ \ mathrm {NaCl} $ ) ao componente puro ( $ \ mathrm {H_2O} $ ) você está tornando possível que o gelo derreta a temperaturas inferiores a 0 ° C.
Como isso se relaciona com as temperaturas de cristalização e derretimento? Dê uma olhada nestes dois diagramas:
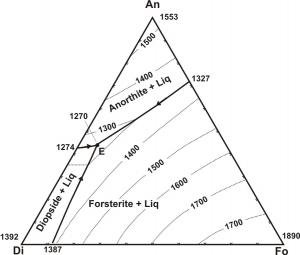
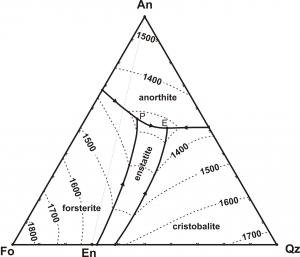 ( fonte)
( fonte)
Estes diagramas descrevem a ordem de cristalização dos minerais em um magma, cuja composição pode ser definida em termos dos três membros finais (Anortita, Diopsídio, Forsterita e Anortita, Forsterita, Quartzo). Uma linha de descendência é uma linha que acompanha a evolução dos minerais em cristalização de um magma. Tome por exemplo um magma com quantidades iguais de Di e Fo e ligeiramente menos An do que o resto. Este magma primeiro cristalizaria apenas forsterita, depois cristalizaria forsterita e diopsídio juntos e, eventualmente, cristalizaria todos os três minerais juntos, até que não houvesse mais líquido. Isso apesar da alta temperatura de fusão da anortita em relação ao diopsídio. O derretimento desta rocha resultaria inicialmente na fusão de todos os três minerais juntos a 1270 ° C, embora suas temperaturas de fusão isoladas variem em torno de 500 ° C.
O segundo diagrama mostra uma situação mais complexa, onde uma rocha com uma composição rica em Fo pode primeiro cristalizar Fo que será então consumida para formar enstatita. Um magma semelhante com um pouco menos do componente Fo pode nem mesmo cristalizar a forsterita, mas sim o quartzo, embora a composição geral ainda seja rica em Fo.
Este assunto de cristalização e derretimento do magma é fascinante e um uma breve introdução está disponível (com muitos recursos visuais) está disponível aqui: Equilíbrio de fase de ensino.